
Керівник – кандидат біологічних наук Дмитро Красненков.
Лабораторія епігенетики створена у 2010 р. на базі лабораторії молекулярної генетики, яку очолював доктор біологічних наук Олександр Якович Літошенко. Керівником лабораторії до 2021 року був доктор медичнх наук, професор Олександр Михайлович ВАЙСЕРМАН
Основні напрями досліджень:
- вивчення ролі епігенетичних процесів (змін експресії генів, не пов’язаних зі змінами у послідовності ДНК) у процесах старіння;
- пошук функціональних взаємозв’язків між генетичними факторами, що беруть участь у контролі тривалості життя;
- використання спектральних методів(раманівської та ІЧ-спектроскопії) для пошуку та аналізу маркерів старіння та стовбуровості;
- дослідження факторів OSKM(Sox2, klf4, oct-4, c-Myc) у молодих і старих тварин;
- дослідження довжини теломер та активності теломерази;
- дослідження маркерів оксидативного стресу;
- дослідження направлені на зменшення кількості соматичних мутацій, що утворюються в процесі культивування культур клітин invitro;
- лабораторія приймала активну участь у розробці методик генотипування SARS-CoV-2, разом з перевіркою клітинного імунітету та авідності антитіл до SARS-CoV-2;
- дослідження ролі miRNAпри атеросклерозі;
- використання повногеномного секвенування для визначення значущих статевих та соматичних мутацій;
- експерименти з генної інженерії та генної терапії старіння;
- застосування методів машинного навчання для побудови моделей біологічного віку.
Співробітниками лабораторії доведено можливість збільшення тривалості життя Drosophila melanogaster за допомогою інгібіторів деацетилаз гістонів, які впливають на експресію генів завдяки модифікації гістонів. Також продемонстровано, що подовжити тривалість життя комах можна за допомогою модифікації умов їх розвитку, а саме зменшення концентрації поживних речовин у кормі, а також збільшення щільності личинкової популяції. Ці зміни пов’язані з суттєвими змінами рівня експресії асоційованих з довголіттям генів.


Визначено асоціацію поліморфних варіантів певних генів з ризиком виникнення хвороб Паркінсона і Альцгеймера в українській популяції. Встановлено, що порушення вуглеводного обміну у людей похилого віку асоційовані з вкороченням довжини теломер лейкоцитів периферійної крові. Виявлено підвищений ризик захворювання на цукровий діабет 2 типу у когорті людей, народжених під час Голодомору 1932-1933 років. Планується продовжити дослідження довгострокових наслідків Голодомору на епігенетичному рівні. В перспективі також визначення довжини теломер і активності теломерази у людей похилого віку з різними залежними від віку захворюваннями.
Лабораторія оснащена сучасним обладнанням кращих світових виробників. Це, зокрема, мікроскоп Fluorescence Olympus, конфокальний раманівський мікроскоп, FTIR спектрометер NicoletIS50 (Thermofisher), ПЛР-ампліфікатор з детекцією у реальному часі (Bio-Rad), інструмент для електрофорезу, планшетний спектрофлюориметр Varioskan Flash (Thermo Scientific) для вимірювання концентрації ДНК/РНК/білка, а також для детекції результатів ELISA, центрифуги G-Force, інкубатори та ламінари для клітинних культур, морозильник -80°С, кельвінатор та контейнери з рідким азотом для зберігання зразків та реагентів, система очищення води Millipore, а також окрема кімната, спеціально обладнана для виділенні ДНК і РНК.


Група дослідження клітинних культур.

Величезне значення у сучасному науковому дискурсі властиве дослідженням на клітинному та тканинному рівні організації. Низка ключових для здорової життєдіяльності процесів можуть вивчатися саме на окремих клітинах та їх популяціях. Перспективи терапевтичного використання клітинних технологій у регенерації виглядають колосальними. Відповідаючи сучасним науково-практичним викликам розвитку цивілізації ми створили потужну та ефективну лабораторію клітинних культур.
Наша лабораторія організована та обладнана згідно з високими вимогами передових науково-дослідних установ. Завдяки творчим високотехнологічним рішенням нам удалось поєднати компактність приміщень з високою ергономічністю. Забезпечити високоякісні асептичні умови роботи. Високотехнологічне обладнання дозволяє працювати майже з будь-якими клітинними лініями. Винахідливі талановиті та харизматичні співробітники мають досвід успішного застосування методів, що перебувають на грані між сучасною наукою та фантастикою.


У нашому арсеналі: повноцінний стерильний бокс зі шлюзовою камерою та притоковою системою вентиляції та відбору повітря через HEPA-фільтри, бокс обладнаний інвертованим світловим мікроскопом, що дозволяє спостерігати живі клітинні популяції, ламінарною шафою 2А класу з повним захистом зразка, найсучаснішими інкубаторами з повним контролем газового складу, потужною центрифугою, та багатьма іншими корисними приладами. Боксу передують базова лабораторія зі світловими мікроскопами, електронними терезами, іншим обладнанням та кріосховище, де зберігаються зразки різноманітних клітинних культур та ліній. При потребі, робочі площі можуть бути швидко масштабовані, завдяки долученню ще кількох приміщень та законсервованого обладнання.
Від початку роботи лабораторії клітинних культур тут було поставлено багато унікальних методик, проведено оригінальні досліди, виконано прогресивні проекти, більшість серед них ми готові виконувати на комерційній основі. Зокрема:
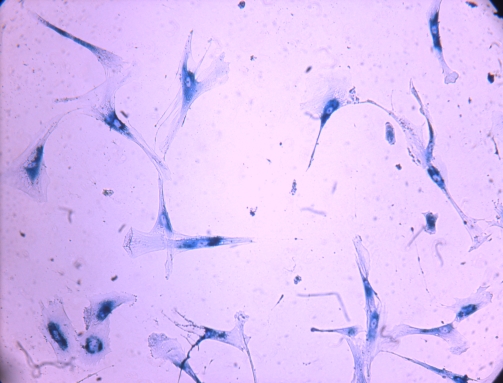
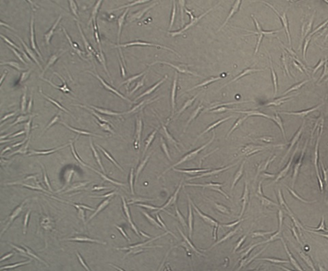
- 1. Отримання первинної культури фібробластів із шкіри людини. Аутологічні фібробласти введенні в культуру у подальшому можуть застосовуватись для різноманітних наукових, медичних та косметологічних задач.
- 2. Культивування фібробластів людини придатних до використання у дослідженнях чи задля косметологічних ін’єкцій, спрямованих на боротьбу зі шрамами та зморшками.
- 3.Дослідження впливу на культури фібробластів різноманітних сполук:
- А) МТТ-тест у різних варіаціях та модифікаціях, зокрема, для визначення токсичного, або стимулюючого ефекту речовини, зустрічний МТТ-тест, для підбору оптимальної комбінації концентрацій двох речовин.
- Б) Тест «Загоєння рани» із впливом різних чинників. Дозволяє дослідити вплив різноманітних сполук на міграційну спроможність клітин.
- В) Тести клітинної адгезії, та впливу різноманітних сполук на прикріплення клітин до субстрату. Тести різних субстратів на токсичність та прикріплення. Серія трьох повторів та контролів.
- Г) Клоногенний аналіз – на встановлення життездатності та здатності до розмноження клітин після впливу певних речовин. У варіації з великими чашками Петрі; у варіації з планшетом.
- 4. Отримання первинної культури аутологічних мезенхімальних стовбурових клітин з жирової тканини. Процедура потребує залучення додаткових фахівців та обладнання. МСК жирової тканини, як і фібробласти, можуть бути використані як з науково-дослідною, так і з медико-косметологічною метою. Їх виділення та культивування складніші та затратніші, але результати застосування більш перспективні.
- 5. Культивування та відбір культури мезенхімальних стовбурових клітин. Із отриманої первинної культури напрацювання біомаси чисельністю у 20 млн клітин.
- 6. Отримання первинної культури мезенхімальних стовбурових клітин із пуповинного канатика. Донорські алогенні мезенхімальні стовбурові клітини пуповини мають високий потенціал до розмноження виробництва корисних речовин та якісний генетичний матеріал. Зважаючи на алогенність (походження з іншого організму) вони можуть бути ефективно застосовані у ізольованих структурах, зокрема у суглобовій капсулі для боротьби з розвитком артрозу. Іх виділення та напрацювання біомаси обсягом у 25 млн. клітин.
- 7. Отримання первинної культури мезенхімальних стовбурових клітин із плаценти. Мають дещо гірші характеристики за мезенхімальні стовбурові клітини виділені із пуповини, але виділяються у більших обсягах.
- 8. Отримання сенесцентних клітин природним шляхом. Унікальна наукова методика. Потрібна переважно в дослідженнях.
- 9. Отримання сенесцентних клітин шляхом стрессорних впливів. Цінна експрес методика, матеріал для досліджень стресостійкості клітин.
- 10. Детекція сенесцентних (старих, ушкоджених, нефункціональних) клітин цитохімічно в тканинах та клітинних культурах.
- 11. Трансдиференціація фібробластів шкіри у клітини жирової та кісткової тканини. Цікаві наукові методики.
- 12. Диференціація мезенхімальних стовбурових клітин з різних джерел у клітини жирової та кісткової тканини. Цікаві наукові методики.
- 13. Автоматизація аналізу сенесцентних клітин. Перспективний науковий проект.
- 14. Розробка методики контрастної детекції сенесцентних клітин паралельно дофарбуванню клітинної популяції. Методика, що покращує ефективність та якість роботи науковців, які досліджують старіння клітин.
- 15. Реконструкція грубоволокнистої кісткової тканини із коллагенових скафолдів та донорських фібробластів. Перспективна регенеративна технологія.
- 16. Реконструкція судинних елементів із децелюляризованих сполучнотканинних патчів та донорських клітин. Перспективний проект, тимчасово призупинено.
- 17. Дослідження впливу концентрацій газів на стабільність геному культур клітин. Дослідження завдяки яким у нашій лабораторії можливе отримання найбільш якісних клітин.
- 18. Дослідження впливу температури культивування на динаміку росту мезенхімальних стовбурових клітин.
- 19. Трансфекція різних типів клітин (первинні та перевивні культури) цільовими генами (з використанням хімічних агентів або електропорації). Цінна методика, для створення культур, які вироблятимуть потрібні сполуки.
- 20. Дослідження клітин на раменовському спектрометрі. Унікальна методика. Наразі роботи призупинено.
- 21. Роботи з імморталізованими клітинними лініями (CHO, HepG2, Hek-293, SKmel, тощо). Проведення досліджень на таких культурах дешевше ніж на первинних фібробластах та МСК, приблизно на 25%.
- 22. Розробка протоколів заморожування клітин та підбір кріопротекторів.
- 23. Розробка протоколів заморожування фрагментів тканини. Та підбір кріопротекторів. Цінні перспективні методики.
- 24. Підвищення життездатності клітин та тканин після заморожування.
- 25. Розробка середовищ культивування та додатків до них.
Також, ми можемо проводити освітню роботу, навчаючи фахівців культивуванню клітин.
Контакти: телефон моб. +38 (050) 216-21-51.


